Разница между газообразным состоянием вещества и твердым или жидким
Одним из агрегатных состояний, свойственных веществам, является газообразное. Оно обладает своими признаками, и речь дальше пойдет о том, чем отличается газообразное состояние вещества от твердого и жидкого.
Твердое и жидкое состояния
Перед тем как перейти непосредственно к газам, рассмотрим, чем характеризуются другие агрегатные состояния.
Твердое
В этом случае частицы вещества максимально сближены. Для них характерны колебательные движения, но не поступательные, поскольку силы притяжения при этом компенсируются силами отталкивания.
Каждая из частиц в твердом теле имеет определенное место в пространстве, и наблюдается их упорядоченность на неограниченном расстоянии (дальний порядок). Все это обуславливает наличие у твердых тел формы и объема, а также крайне малую сжимаемость.
Жидкое
Такое состояние характеризуется некоторой взаимной отдаленностью молекул. Силы их притяжения уменьшаются, имеет место поступательное движение частиц, отличающееся хаотичностью.
Упорядоченность частиц присутствует только на малых расстояниях (ближний порядок).
Это проявляется в таких свойствах жидкостей, как меньшая, чем у твердых тел, плотность и отсутствие собственной формы (она зависит от формы предоставленной емкости). Однако жидкости имеют объем, практически не зависящий от давления.

Сравнение
Теперь перейдем к основному вопросу и рассмотрим отличие газообразного состояния вещества от твердого и жидкого.
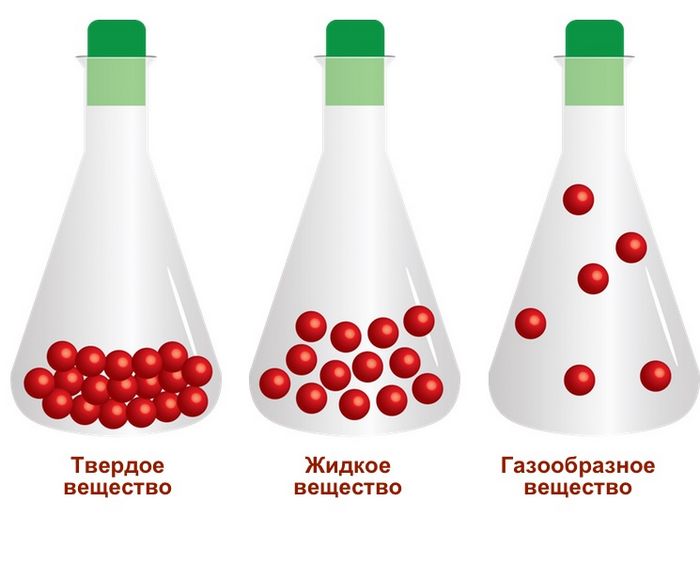
Если для других состояний характерна определенная упорядоченность частиц, то газообразному свойственно их независимое друг от друга расположение и отсутствие дальнего или ближнего порядка.
2. Свойства вещества
Расстояние между молекулами, образующими газ, наибольшее по сравнению с твердыми и жидкими телами. Они передвигаются максимально хаотично, взаимодействуя незначительно.
Такое расположение частиц обеспечивает маленькую плотность газов и отсутствие у них собственной формы.
Еще одним признаком, указывающим на то, в чем разница между газообразным состоянием вещества и твердым или жидким, является способность газов заполнять все имеющееся пространство.
Фиксированного объема у газов нет. Эта характеристика меняется при изменении давления.
Газам присуща высокая сжимаемость.
Агрегатные состояния вещества: твердое жидкое и газообразное. Влияние температуры, давления и примесей
Существует три основные состояния вещества — газообразное, жидкое и твердое. В физике эти состояния называют агрегатными.
Итак, агрегатное состояние вещества называют физическое состояние, которое напрямую зависит от таких основных характеристик как давление и температура.
Пребывая в том или ином состоянии, веществам свойственны разнообразные структуры.
Кроме перечисленных трех основных агрегатных состояний существуют и другие, но мы в рамках статьи не будем в них углубляться.

Влияние энергии движения частиц на свойства агрегатных состояний веществ
Как известно, любое вещество состоит из молекул, которые в свою очередь делятся на атомы. В качестве частиц кроме молекул могут рассматриваться и ионы, в которые превращаются атомы или их группы.
На самом деле, ионы или молекулы имеют сложную форму построения, но для упрощения их построения и создания визуальной наглядности их представляют в сферическом виде.
Абсолютно во всех веществах сила взаимного притяжения между их частицами препятствуют их передвижению друг относительно друга.
Тепловое расширение
Однако с ростом температуры кинетическая энергия частиц начинает расти и тем создавая все большее противодействие силе притяжения между частицами. Агрегатное состояние вещества зависит от отношения приобретенной кинетической энергии частицы к силе их взаимного притяжения.
Проще говоря, от того, насколько свободно и дальше может «гулять» молекулы относительно других и зависит текущее физическое состояние вещества.
Изменяя показатели температуры и давления можно наблюдать переход из одного состояния в другое.
Самый распространенный пример перехода из одного состояния в другое в жизни можно наблюдать на примере трех состояний молекулы воды: твердом в качестве льда при температуре ниже 0 0С, жидком при температуре выше 0 0 С и газообразном паре, который образуется после закипания воды при температуре 100 0 С и выше.

На этом графике показано, как изменяется энергия частиц вещества в твердом, жидком и газообразном состояниях.
Чем больше энергия, тем быстрее частицы движутся или колеблются.
Небольшая доля частиц обладает очень низкой или очень высокой энергией.
ВОЗГОНКА ЙОДА ИЛИ СУБЛИМАЦИЯ
Твердое агрегатное состояние
В твердых веществах за счет сильного взаимного притяжения у частиц нет возможности развивать необходимую кинетическую энергию и тем самым передвигаться свободно от заданной позиции при условии сохранения текущей температуры и давления. Частицы твердых веществ располагаются тесно друг от друга и образуют определенную структуру, которую называют кристаллической решеткой.
Эталонным примером регулярной кристаллической решетки является кристалл.
Жидкое агрегатное состояние
Отличительным свойством жидкости является их текучесть, вследствие чего они способны менять свою форму. Жидкость, налитая в сосуд, моментально принимает его форму и под воздействием гравитационной силы Земли располагается на его дне.
Граница верхней поверхности жидкости при этом образует гладкую плоскость. Кинетическая энергия движения молекул воды превосходит их взаимное притяжение, которое не способно в свою очередь удержать их не месте.
Молекула воды словно перекатывается от одной к другой создавая видимую нашим глазом текучесть.
Жидкость, в отличие от твердых тел, не имеет кристаллической решетки.
Газообразное агрегатное состояние
Газообразное вещество как и жидкость заполняет сосуд, только в отличии от жидкости — весь его объем. Прощу говоря, наполовину налитая жидкость в сосуд не может заполнить весь ее объем, а газ может.
Это достигается благодаря очень высокой кинетической энергии молекул газа, которая в разы превосходит энергию их взаимного притяжения, а также гравитационную силу. Поэтому газ не скатывается как жидкость на дно сосуда.
Газ, как и жидкость не имеет кристаллической решетки в отличии от твердого тела.
Взаимное расположения между молекулами газа свободно изменяется, что позволяет различным телам проходить сквозь его молекулы.
Точка плавления
Физические агрегатные состояния веществ способны переходить с одного вида в другие — из твердых в жидкие, из жидких в газообразные при изменении их температуры. Изменение температуры ведет к увеличению или к уменьшению кинетической энергии.
Переход твердого вещества в жидкое называют плавлением.
Границу перехода из твердого состояния в жидкое задает так называемая точка плавления с температурой, способной возбудить кинетическую энергию в частице, которой будет достаточно, чтобы отделиться от своего стационарного положения кристаллической решетки.
Чем больше температура, тем больше передаваемая кинетическая энергия частицам элемента. Чем сильнее сила притяжения между частицами, тем больше необходимо создать кинетической энергии для высвобождения частиц из кристаллической решетки.
Во время литья расплавленное (раскаленное добела) железо выливается в приготовленную форму.

При температуре ниже 1535 0 С железо затвердевает, принимая вид литейной формы.
Температура плавления вещества зависит от сил притяжения составляющих его частиц.

Для гелия эти силы настолько малы, что он становится твердым при давлении по крайней мере в 25 раз выше атмосферного.
Точка кипения
Пожалуй, самое распространенное явление перехода жидкого состояния в газообразное в быту — это кипение воды. Заваривая чай каждый из нас мог наблюдать рождение процесса кипения воды.
Маленькие пузырьки пара в толще подогревающейся воды постепенно растут и достигая критических размеров начинают подниматься на поверхность, где лопаясь превращаются в газообразное состояние — пар.
Как и в случае с плавлением существует граничная температура, называемая точкой кипения, при которой кинетическая энергия становится достаточной для того, чтобы преодолеть силы взаимного притяжения частиц, не дающие оторваться друг от друга и покинуть занимаемый объем. Любой элемент таблицы Менделеева или вещество из нескольких элементов имеет свою точку кипения. Чистая дистиллированная вода (H2O) имеет температуру кипения 100 0 С, этиловый спирт — (-79 0 С), а высококонцентрированная серная кислота кипит при температуре 338 0 С.
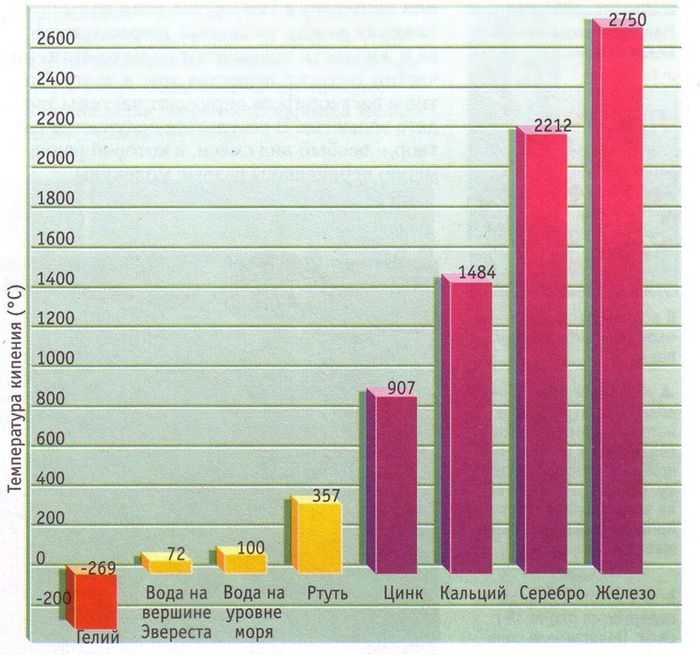
Температура кипения также зависит от давления и сил притяжения между частицами.
Однако, существуют исключения, при котором вещества могут миновать при переходе из одного агрегатного состояния в другую целую фазу превращения — переходя из твердого сразу в газообразную. Этот эффект называют сублимацией или возгонкой.
Видео подборки опытов с сухим льдом
В качестве примера можно привести превращение сухого льда (диоксид углерода в твердом виде сразу в газообразное при температуре -78,5 0 С.
Влияние давления и различных примесей на кипение или плавление
Вторым фактором, влияющим на агрегатное состояние вещества это давление. Повышая давление сила прижатия одной частицы вещества к другой растет, и таким образом необходимо для перехода из одного состояния в другое приложить большую кинетическую энергию (температуру).
Образуется следующая взаимосвязь: температура кипения и плавления растет при повышении давления.
Примеси в частицах вещества также влияют на фактическую температуру плавления или кипения за чтоб того, что они влияют на существующие силы притяжения между частицами.
Одним из ярких примеров влияние примесей — рассыпанные кристаллы соли на льду, которые заставляют лед превращаться в жидкость при температуре окружающей среды ниже нуля.
Разница между твердым, жидким и газообразным

Все, что нас окружает, такие как воздух, еда, вода, растения, животные, транспортные средства, одежда и т. Д., Состоит из материи. Вещество — это совокупность частиц, и все, что имеет массу и занимает пространство.
Существует три основных состояния вещества: твердое, жидкое и газообразное. Состояния вещества происходят из-за изменений в молекулах вещества.
Размер и форма твердого объекта являются определенными.
Тем не менее, если мы говорим о двух других состояниях вещества, то есть жидкости и газа, то жидкости текут, принимая форму стакана, и газы диффундируют, чтобы полностью заполнить имеющийся объем.
Основное различие между твердым телом, жидкостью и газом заключается в их свойствах, которые мы собираемся обсудить в этой статье.
Сравнительная таблица
| Имея в виду | Твердый относится к форме вещества, которое имеет структурную жесткость и имеет твердую форму, которую нельзя легко изменить. | Жидкость — это вещество, которое свободно течет, имеет определенный объем, но не имеет постоянной формы. | Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен. |
| Форма и Объем | Фиксированная форма и объем. | Нет фиксированной формы, но имеет объем. | Ни определенной формы, ни объема. |
| энергии | низший | Средняя | Наибольший |
| сжимаемость | Сложно | Почти сложно | Легко |
| Расположение молекул | Регулярно и тесно организовано. | Случайно и немного редко устроены. | Случайный и более редкий. |
| жидкотекучесть | Не может течь | Потоки с более высокого уровня на более низкий. | Протекает во всех направлениях. |
| Молекулярное движение | Незначительное молекулярное движение | Броуновское молекулярное движение | Свободное, постоянное и случайное молекулярное движение. |
| Межмолекулярное пространство | Очень меньше | Больше | большой |
| Межмолекулярное притяжение | максимальная | Средняя | минимальный |
| Скорость звука | Самый быстрый | Быстрее, чем газ, но медленнее, чем твердый | Самый низкий среди всех |
| Место хранения | Не нужен контейнер для хранения. | Не может храниться без контейнера. | Необходим закрытый контейнер для хранения. |
Определение твердого тела
Под термином «твердый» мы понимаем тип материи, которая имеет жесткую структуру и противостоит изменению ее формы и объема. Частицы твердого тела плотно связаны и хорошо расположены в правильном порядке, что не позволяет частицам свободно перемещаться из одного места в другое.
Частицы постоянно вибрируют и крутятся, но движения нет, так как они находятся слишком близко друг к другу.
Как межмолекулярное притяжение максимально в твердых телах, так и потому, что их форма фиксирована, а частицы остаются там, где они установлены.
В дополнение к этому сжатие твердого тела очень жесткое, так как пространства между молекулами уже очень меньше.
Определение жидкости
Свободно текучее вещество постоянного объема, имеющее консистенцию, называется жидкостью. Это тип материи, который не имеет своей формы, но принимает форму сосуда, в котором он находится.
Он содержит мелкие частицы, которые крепко удерживаются межмолекулярными связями. Одним из уникальных свойств жидкости является поверхностное натяжение, явление, при котором жидкость обладает минимальной площадью поверхности.
Сжатие жидкости практически затруднено из-за меньшего зазора между частицами. Частицы тесно связаны, но не так тесно, как в случае твердого тела.
Таким образом, частицы могут двигаться и смешиваться друг с другом.
Определение газа
Газ описывается как состояние вещества, которое свободно распространяется во всех направлениях и заполняет все доступное пространство, независимо от количества. Он состоит из частиц, которые не имеют определенной формы и объема.
Частицы могут быть отдельными атомами или элементарными молекулами или составными молекулами.
В газах молекулы слабо удерживаются, и поэтому между молекулами много свободного пространства для свободного и постоянного движения.
Благодаря этой характеристике, газ обладает способностью заполнять любой контейнер, а также может быть легко сжат.
Основные различия между твердым веществом, жидкостью и газом
Разница между твердым веществом, жидкостью и газом может быть четко определена по следующим причинам:
- Вещество, обладающее структурной жесткостью и имеющее твердую форму, которую трудно изменить, называется твердым веществом. Водоподобная жидкость, которая течет свободно, имеет определенный объем, но не имеет постоянной формы, называется жидкостью. Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен.
- Хотя твердые вещества имеют определенную форму и объем, жидкости имеют только определенный объем, но не форму, газы не имеют ни формы, ни объема.
- Уровень энергии самый высокий в газах, средний в жидкости и самый низкий в твердых веществах.
- Сжатие твердых частиц затруднено, жидкости почти несжимаемы, но газы легко сжимаются.
- Молекулярное расположение твердых веществ является регулярным и близким, но жидкости имеют неправильное и редкое молекулярное расположение, а газы также имеют случайное и более редкое расположение молекул.
- Молекулярное расположение в твердых телах хорошо организовано. Однако в случае жидкостей слои молекул скользят и скользят друг над другом. Напротив, частицы в газах совсем не организованы, из-за чего частицы движутся случайно.
- Когда дело доходит до текучести, твердые вещества не могут течь, однако жидкости могут течь, и это также от более высокого уровня до более низкого уровня. В отличие от этого газы текут во всех направлениях.
- Пространства между молекулами и кинетической энергией минимальны в твердых телах, средние в жидких и максимальные в газах. Таким образом, движение молекул незначительно в твердых телах, тогда как в жидкостях наблюдается беспорядочное, случайное движение молекул. В отличие от газов, которые имеют свободное, постоянное и случайное движение молекул.
- В твердых телах частицы плотно удерживаются сильным межмолекулярным притяжением, хотя в жидкостях притяжение между частицами является промежуточным. В отличие от этого частицы слабо удерживаются, потому что межмолекулярное притяжение слабое.
- Скорость звука самая высокая в твердых телах, а скорость немного ниже в жидкостях и минимальная в газах.
- Поскольку твердые вещества имеют определенную форму и размер, им не требуется контейнер для хранения. Жидкости нельзя хранить без контейнера. И наоборот, для хранения газов необходим закрытый контейнер.
Изменение в состоянии материи
Вещество меняет свое состояние от одной формы к другой, когда нагревается или охлаждается, что подпадает под физическое изменение. Итак, ниже приведены некоторые процессы, посредством которых состояние вещества может быть изменено:
5 ГЛУПЫХ ВОПРОСОВ / Школьники отвечают на школьные вопросы за 2 месяца до ЕГЭ
- Плавление : процесс превращения твердого вещества в жидкость.
- Замораживание : процесс, который помогает в превращении жидкости в твердое вещество.
- Испарение : процесс, используемый для превращения жидкости в газ.
- Конденсация : процесс, при котором газ превращается в жидкость.
- Сублимация . Когда твердое вещество превращается в газ, оно называется сублимацией.
- Описание : процесс, посредством которого газ превращается в твердое вещество.
Заключение
Следовательно, в этой статье мы узнали, что вещество присутствует в трех состояниях: твердое тело, жидкость и газ. Кроме того, состояние вещества являются взаимозаменяемыми, то есть форма может быть изменена путем изменения температуры или давления.