Ион и изотоп 2020
Ион против изотопа
Вся материя состоит из атомов, состоящих из отрицательно заряженных электронов, окружающих центральное ядро.
Ядро образуется с благоприятно заряженными протонами и нейтральными нейтронами, а электроны держатся вместе электромагнитной силой.
Атом, который вероятно будет отрицательно или благоприятно заряжен, именуется ионом.
Ион образуется если есть наличие электронного дефицита или излишка; в данном случае дефицит означает благоприятно заряженный атом или ион, тогда как излишек означает отрицательно заряженный атом или ион. Этот излишек или дефицит привел бы к полному числу электронов, которое не равно общему числу протонов в ядре и заставляет атом источать электрический заряд.
Ион состоит из одного атома и именуется атомным или одноатомным ионом или состоит из нескольких атомов и именуется молекулярным или многоатомным ионом. Ионы в большинстве случаев попадаются в природе.
Они производятся в твёрдом, жидком или газообразном состоянии.
Они случаются в молнии, электрических искрых и пламени в их газовом состоянии, а в их твёрдом или жидком состоянии они появляются, когда соли взаимодействуют с экстрагентами, например как ион ионов в морской воде.
Они дают ювелирные камни их цвета через поглощение света ионами металлов, и они предоставляют солнце люминесценцией.
Задача 21 ВАРИАНТ 3 Профильный ЕГЭ по физике Лукашов 50вар. Решение/Разбор Р0001113
Плюс к этому, они актуальны в биохимии и разрушении аденозинтрифосфата (АТФ).
Слово «ион» было дано английским физиком Майклом Фарадеем конкретному виду, который применяет водную среду при переносе между электродами.
Это происходит от греческого слова «iov», что означает «движение».
С другой стороны, слово «изотоп» происходит от греческого слова «в том же месте», которое Маргарет Тодд предложила Фредерику Содди, который обнаружил его, когда он изучал цепи радиоактивного распада между ураном и свинцом.
В атоме есть различные количества протонов и нейтронов. Его элемент химии ставится числом протонов, а изотоп элемента определяется числом нейтронов, которое оно имеет.
Изотоп есть, когда в атоме есть дефицит или излишек нейтронов. Атомы в установленном элементе обязаны иметь одинаковое кол-во протонов, но могут иметь самое разное кол-во нейтронов.
Это заставляет компонент иметь несколько изотопов, которые имеют сходные химические свойства и поведение. Есть две спецификации изотопов: стойкие и нестабильные.
Стабильными изотопами считаются те, которые не автоматично разлагаются. Нестабильными изотопами считаются те, которые автоматично разлагаются и излучают ионизирующее излучение.
1. Это благоприятно или отрицательно заряженные атомы, а изотопы — различные варианты атомов в элементе. 2.
Имеются, когда в атоме есть дефицит или излишек электронов, а изотопы есть, когда в атоме есть дефицит или излишек нейтронов.
3. Изотопы могут быть стабильными (не автоматично разлагающимися) или нестабильными (автоматично затухающими), тогда как ионы могут быть атомарными (состоящими из одного атома) или молекулярными (состоящими из нескольких атомов).
Г). Что общего у разных изотопов одного и того же элемента химии? Чем они отличаются?
Изотопы – это разновидности данного элемента химии, отличающиеся массовым числом собственных ядер.
Общее: аналогичный ядерный номер Z , заряд ядра содержит одинаковое число протонов, одинаковое строение электронных оболочек, кол-во электронов в электрнейтральном атоме, изотопы обладают фактически похожими химическими характеристиками.
Отличаются количеством нейтронов в ядре, массовым числом собственных ядер, отличается стабильность атомов, у неустойчивых ядер отличается время полураспада, физические свойства изотопов различаются достаточно резко
2. Точечный изотропный источник испускает свет с длиной волны 589 нм.
Мощность света источника Р=10Вт. Найти: а)среднюю плотность потока фотонов на расстоянии r=2,0 м от источника; б)расстояние от источника до точки, где средняя концентрация фотонов п=100 1/см 3 .


2. Муфельная печь потребляет мощность Р=1кВт.
Температура Т ее поверхности внутри при открытом отверстии площадью S=25 см 2 равна 1200К. Полагая, что отверстие печи излучает как черное тело, определить, какая часть мощности рассеивается стенками

а). Запишите формулу Рэлея-Джинса для излучения тепла.
Что знаменитый физик Эренфест имел – в виду, когда говорил об "ультрафиолетовой катастрофе"?
Формула Рэлея-Джинса для излучения тепла:
(1)
Формула Рэлея-Джинса для испускательной способности
(2)
Интегрирование выражения (2) по всему частотному диапазону даёт бесконечно огромное значение, т.е. энергетическая светимость полностью черного тела должна равняться бесконечности при любой температуре.Фактически вся энергия нагретого тела должна быть немедленно испущена в виде излучения с очень высокой частотой и небольшой длиной волны. Такой результат назвали «ультрафиолетовой катастрофой Рэлея-Джинса»
б). Почему в спектре водорода так много линий, если у атома водорода только один электрон?


Энергия электрона в атоме слагается из кинетической энергии движения по орбите и возможный энергии в электрическом поле ядра.
[Урок по химии] Изотопы
Энергия электрона на круговой орбите, а значит , и энергия атома в общем зависят от радиуса орбиты: меньшему радиусу орбиты отвечает меньшая энергия атома.
Химия 11 класс (Урок№1 — Хим. элемент. Нуклиды. Изотопы. Законы сохранения массы и энергии в химии.)
Из квантовой механики следует, что энергии электронов в атомах могут принимать только некоторые дискретные значения. Состояния, отвечающие этим значениям энергии, называются энергетическими уровнями.
Т.к. энергия определяется радиусом орбиты, то каждому энергетическому уровню атома отвечает орбита конкретного избранного радиуса. Ключевому энергетическому уровню атома отвечает орбита наименьшего радиуса.
На Дерибасовской Хорошая Погода, или На Брайтон Бич Опять Идут Дожди. Фильм. Комедия
Хорошо электрон находится на этой орбите. При сообщении очень большой энергии( при столкновении между собой) электрон переходит на другой энергетический уровень, т.е. перескакивает на одну из внешних орбит.
В этом возбужденном состоянии атом неустойчив.
Через определенный промежуток времени электрон переходит на невысокий уровень, т.е. перескакивает на орбиту меньшего радиуса. При переходе электронов на более невысокие уровни излучаются спектральные линии.
Совокупность линий, отвечающих переходам на одинаковый нижний уровень, образовывает спектральную серию. Переход электрона с дальней орбиты на ближнюю сопровождается испусканием светового кванта.
При переходе электрона с уровней
на ключевой уровень
излучаются спектральные линии Сирии Лаймана (они лежат в незаметной ультрафиолетовой области спектра). При переходе электрона на уровень
с уровней
излучаются спектральные линии серии Бальмера (они лежат в видимой оптической области).
При переходе электрона на уровень
с больших уровней
излучаются линии серии Пашена (они лежат в незаметной инфракрасной области спектра). Имеются и остальные серии линий в спектре атома водорода, подходящие переходам на уровни
с более больших уровней.
в). Каков физический смысл коэффициентов Эйнштейна для спонтанного излучения, резонансного поглощения, вынужденного излучения?
Коэффициенты Эйнштейна формируют допустимости переходов атомов с уровня
на уровень
при спонтанном излучении
. Вероятность вынужденного перехода пропорциональна спектральной объемной плотности энергии
вынужденного излучения с частотой
.
Коэффициенты
— называются коэффициентами Эйнштейна. Они зависят от направления процесса, и определяются только начальным и конечным состояниями атома:
.
г). Как изменится положение элемента химии в таблице Менделеева после испускания его ядром гамма-кванта?
2.
Короткий импульс света с энергетикой Е=7,5 Дж в виде узкого практически параллельного пучка падает на зеркальную пластинку с коэффициентом отражения р=0,60.
Угол падения пучка равён 30°. Определить при помощи корпускулярных представлений импульс, переданный
пластинке.


2. Определить, какая часть (в процентах) начального количества ядер радиоактивного изотопа остается нераспавшейся после того как закончилось время t, равного трем средним временам жизни радиоактивного ядра.
Разница между изотопами одного элемента
Установлено, что любой элемент химии, который находится в природе – это смесь изотопов (отсюда у них дробные атомные массы). Чтобы понимать, как отличаются изотопы один от иного, стоит подробно рассмотреть строение атома.
Атом образовывает ядро и электронное облако. На массу атома оказывают влияние электроны, двигающиеся с ошеломительной скоростью по орбиталям в электронном облаке, нейтроны и протоны, входящие в состав ядра.
Обозначение
Изотопы – это разновидность атомов какого-нибудь элемента химии. Электронов и протонов в любом атоме всегда равное кол-во.
Потому как они обладают противоположными зарядами (электроны – негативным, а протоны – позитивным), атом всегда нейтрален (эта простая частичка не несет заряда, он равён у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо негативным, либо позитивным ионом.
Нейтроны не имеют заряда, зато их кол-во в ядре атома одного и того же элемента бывает разным. Это совсем не проявляется на нейтральности атома, впрочем оказывает влияние на его массу и свойства.
К примеру, в любом изотопе атома водорода есть по одному электрону и протону. А кол-во нейтронов различное.
В протии есть только лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа ощутимо друг от друга отличаются по своим характеристикам.
Сравнение
В них различное кол-во нейтронов, неодинаковая масса и разные свойства. Изотопы обладают похожим строением электронных оболочек.
Это означает, что они довольно близки по химическим особенностям.
Благодаря этому им отведено в периодической системе одно место.
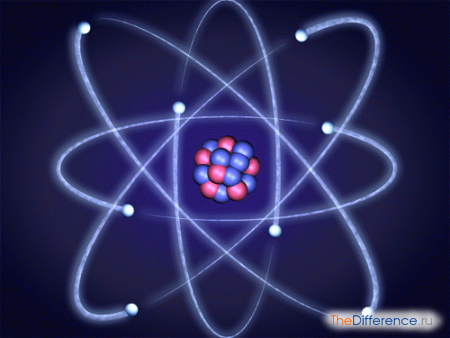
В природе обнаружены изотопы стабильные и радиоактивные (неустойчивые). Ядра атомов радиоактивных изотопов способны самопроизвольно трансформироваться в прочие ядра.
В процессе радиоактивного распада они испускают разные частицы.
Большинство элементов имеет более 2-ух десятков радиоактивных изотопов. Более того радиоактивные изотопы искусственно синтезированы полностью для абсолютно всех элементов.
В естественной смеси изотопов их содержание несущественно колеблется.
Существование изотопов дало возможность понять, почему в некоторых случаях детали с меньшей атомной массой обладают большим порядковым номером, чем детали с большей атомной массой.
К примеру, в паре аргон-калий аргон включает тяжёлые изотопы, а калий – легкие изотопы. Благодаря этому масса аргона больше, чем калия.
Разница между изотопами одного элемента
Что одинаково у атомов различных изотопов одного элемента химии, и что у них различно?