Кислоты, щелочи и основания с точки зрения химии
Что же собой представляют кислоты, щелочи и основания с химической точки зрения? Читай с большим вниманием и запоминай.
Смотри не запутайся!
Что такое кислота?
Кислоты собой представляют молекулы, которые при растворении в водной массе высвобождают ион водорода. Ионы — это благоприятно и отрицательно заряженные частицы, которые придают кислотам их свойства.
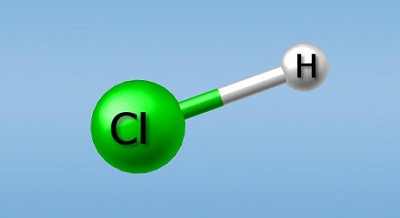
Давай рассмотрим данный процесс на примере соляной кислоты — HCI. Если соляную кислоту объединить с водой, она распадется на ион водорода (Н+) и ион Cl (CI ). Так как в составе водяные молекулы также есть водород, то при распаде соляной кислоты общее кол-во ионов водорода в растворе становится больше.
А что происходит со щелочами при попадании в воду? В водной массе щелочи высвобождают гидроксид-ионы.
К примеру, гидроксид натрия (NaOH) — щелочь. При соединении с водой он распадается на ионы Na (Na+) и гидроксид-ионы (ОН ). Когда гидроксид-ионы встречаются с ионами водорода воды, общее кол-во ионов водорода в растворе уменьшается.
Что подобное основание?
Основание — это соединение, химически противоположное кислоте. В состав основания входят ионы металлов и связанные с ними гидроксид-ионы.
Эти вещества способны подсоединять ионы водорода (Н+) из кислоты. Когда основание перемешивается с кислотой, оно полностью остановит его свойства, а в результате реакции образуется соль.
К примеру, с точки зрения химии хорошо знакомая тебе зубная паста — это основание, которое остановит кислоту, оставшуюся во рту после еды.
ЗАПОМНИ!
Из-за того, что ионы есть только в растворах, собственные свойства кислоты показывают также лишь в растворах.
Что такое щелочь?
Щелочи — это соединения, в их состав входят ион металла и гидроксид-ион (ОН-). К щелочам химики относят гидроксиды щелочных и щелочноземельных металлов.
Щелочи собой представляют белые вещества, которые хорошо растворяются в водной массе. Кроме того, растворение всегда сопровождается очень активным выделением тепла.
Щелочи вступают в реакцию с кислотами, образовывая соль и воду.

Щелочи очень активны!
Они могут поглощать из воздуха не только пары перегретые, но и молекулы углекислого газа, сероводорода и т.д. Благодаря этому хранят щелочи в очень герметичной таре.
Концентрированные щелочи разрушают стекло, а порой даже фарфор. Если сопоставлять щелочи с кислотами, то щелочи могут вызвать более сильные ожоги, так как они достаточно стремительно проникают в ткань, и их как правило невозможно смыть водой.

Шкала pH
Почему одни жидкости — кислоты, а иные — щелочи? Оказывается, дело все в типе ионов.
Если в жидкости выше концентрация ионов водорода, такая жидкость считается кислотой, а если гидроксид-ионов, то щелочью.

Шкала pH применяется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в границах 0—7, то раствор такого типа считается кислотным, при этом раствор с pH = 0 — самый кислый.
Растворы с pH в границах 7—14 являются щелочами, при этом раствор с pH = 14 является самым едким и опасным.
Если pH раствора равён 7, то раствор такого типа считается нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов.
Пример нейтрального раствора — чистая вода.
Что такое критерий pH?
Если перевести с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в растворе воды.
Как химики формируют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, но даже при небольшом количестве воды он становится синим.
Концентрированные кислоты и щелочи
токсичные жидкости находятся не только в школьных лабораториях, они и нас окружают. Это самые разные средства домашней химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизтопливо, аккумуляторные, тормозные и другие технические жидкости, а в кухонной комнате — уксус и кислота уксуса.
Вполне понятно, что все упомянутые выше вещества должны применяться строго по назначению и в согласии с некоторыми правилами, указанными на бирке каждого средства. К большому сожалению, несоблюдение мер безопасности во время работы с токсичными средствами может привести к большим проблемам со здоровьем: отравлению, разным повреждениям кожи и слизистых оболочек.
ВНИМАНИЕ! Обязательно запомни такую информацию: кислоты с слишком низким критерием pH (менее 2) и щелочи, pH которых выше 13, являются чрезвычайно опасными!
Кислоты и щелочи в природе
Ты уже успел удостовериться в том, что нас окружают — большое количество кислот и щелочей. Продукты из молока, овощи и фрукты содержат лимонную, яблочную, щавелевую, уксусную, молочную, аскорбиновую и остальные кислоты.
Сложно верить, однако в косточках вишен и миндаля содержится (хотя и в небольших количествах) такой крепкий яд, как синильная кислота! Известно, что многие насекомые предпочитают защищаться всевозможными кислотами.
Кислоты. Химия 8 класс
Никогда не думал, почему укусы обычного крошечного муравья бывают такими болезненными? А все из-за того, что он вспрыскивает в ранку капельки муравьиной кислоты.
Эту же кислоту выделяют и кое-какие виды гусениц, а тропические пауки и некоторые жуки защищаются от врагов с помощью уксусной и серной кислот.
ОСТОРОЖНО!
В основном, концентрированные кислоты и щелочи присутствует во всех школьных каби нетаххимии, и пользоваться ими можно только под управлением учителя.
Использование щелочей
Щелочи широко применяются в самых разных сферах промышленности, медицине и быту. К примеру, каустическая сода применяется для растворения жиров и входит в состав многих средств для мытья, применяется во время изготовления целлюлозы, масел, ДТ.
Также щелочи применяют для изготовления мыла, искусственных волокон, разных красителей и т.д.
Кислоты в почве
Оказывается, кислоты есть и в почвах, а способность почвы выражать свойства кислот именуется кислотностью. Данный показатель зависит от наличия в земля ионов водорода.
От кислотности почвы зависят рост и развитие растений.
Многие из них предпочитает нейтральные или близкие к ним почвы. Но имеются ряд растений, которые превосходно себя ощущают собственно на кислотных почвах, к примеру рододендроны, гортензии, азалии.
Некоторые сорта гортензии могут менять цвет бутонов в зависимости от условий выращивания и кислотности почвы. Ученые выяснили, что на цвет бутонов оказывает влияние наличие алюминия!

Большинство садовых почв отличается достаточным содержанием такого элемента. В кислой обстановке соединения алюминия превращаются в растворимые и становятся доступными для растений, благодаря этому и отрастают бутоны голубого цвета.
�� Насколько ОПАСНО для человека СРЕДСТВО ДЛЯ ЧИСТКИ ТРУБ и ЩЕЛОЧЬ? Техника безопасности важна!
В нейтральной или щелочной обстановке алюминий находится в виде нерастворимых соединений, благодаря этому он и не поступает в растения. В результате на подобных почвах растут бутоны розового цвета.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм применяет желудочный сок, в его состав входят соляная кислота и разные ферменты. Иногда, тем более после переедания, мы можем ощутить желудочных болей . Очень часто для снимания малоприятных чувств достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке.
В основном, все антациды — щелочи, и непосредственно они нейтрализуют очень высокую активность кислот.
Как отличаются кислоты от щелочей


Слово «кислота» происходит от латинского слова «кислый».
Некоторые продукты с нашего стола, например, уксус или сок лимона, — кислоты.
Основание — соединение, химически противоположное кислоте, и при реакции с кислотой даёт нейтральное соединение — соль. Растворимые в водной массе основания называются щелочами.
В цитрусовых плодах — грейпфрутах, апельсинах лимонах — содержатся лимонная и аскорбиновая кислоты. Яд пчелы – кислота.
Остановить её можно Основанием.
В цитрусовых плодах – грейпфрутах, апельсинах, лимонах – содержится лимонная и аскорбиновая кислоты.
Кислоты содержат атомы водорода (катион) и кислотный остаток (анион). Щелочи содержат атомы металла (катион) и гидрокисильную группу ОН (анион).
Это основные определения.
Кислоты и щёлочи выделяют по показателям pH (шкала pH).
Ниже Вы видите картинку – это специализированная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь.
Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10?
Серединой в большинстве случаев считают число 7 (нейтральное положение). Другими словами числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для такой шкалы разработаны специализированные индикаторы — лакмусы. Это простая полоска, которая откликается на среду.
В кислотной обстановке она красится в красный цвет, а в щелочной обстановке – в синий цвет.
Она нужна не только в химии, но и в бытовых условиях.
К примеру, если у Вас есть аквариум, то очень важную роль играет кислотность воды.
От неё зависит вся жизнь аквариума.
Например, критерий кислотности воды для аквариумных рыбок меняется от 5 до 9 рН. Если будет меньше либо больше, то рыбка себя будет чувствовать не удобно, а может и совсем скончаться. Все это же самое и с растительностью для аквариумов…

Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в водной массе.
Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»).
Собственно ионы придают кислотам их свойства, но существовать они могут только в растворе. Поэтому, свойства кислот появляются исключительно в растворах.
Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор.
Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным.
На контейнерах с сильными кислотами ставят принятые во всем мире символы, означающие «страшно» и «большая активность»Сила кислоты измеряется числом рН — водородным критерием. Сильные кислоты очень агрессивны; попав на поверхность предмета или на поверхность кожи, они прожигают её.
На контейнерах с сильными кислотами ставят принятые во всем мире символы, означающие «страшно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. изготовленные живыми организмами, называются органическими.
Кислоты повсеместно используются в химической и медицинской промышленности, в производстве пищевых продуктов и волокон синтетики.
Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота.
В цветных пятнах на кожных покровах морских улиток содержится кислота с малоприятным вкусом, отпугивающая хищников.
Для абсолютно всех кислот отличительно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода.
Реакции кислот с большинством металлов дают соль и водород.
Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Знаменитый кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту.
Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе.
Число рН меняется от 0 до 14.
Чем меньше рН, тем больше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота.
Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральные, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить при помощи индикатора.
Указатель — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи.
�� Как растворить труп в щелочи – ресомация ☠️ [Modern Rogue на русском]
Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из обычных растений, именуемых лишайниками.
Прочие растения, к примеру, гортензия и краснокочанная капуста, также считаются натуральными индикаторами.

Говоря иначе многофункциональный указатель – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества.
Он становится красным, оранжевым или жёлтым в кислотах, зеленым или жёлтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота занимает важное место в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве волокон синтетики, красителей, пластмасс, лекарственных средств, взрывчатых веществ, средств для мытья, автомобильных аккумуляторов.
Когда-то серную кислоту величали минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота довольно активна и агрессивна.
При растворении в водной массе она выделяет много тепла, благодаря этому ее необходимо вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород иным веществам.
Серная кислота также считается осушителем, т.е. забирает воду, связанную с иным веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений.
На меловых и известняковых породах почва в большинстве случаев щелочная, а на лугах, в песчаных и лесистых районах она более кислая.
Кислотность также увеличивают кислотные дожди. Для земледелия наиболее целесообразно подойдут нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листы образовывают органическую гуминовую кислоту и увеличивают кислотность почвы.
Там, где почвы слишком кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии активно растут на кислотных почвах.
Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – настоящий указатель.
На кислотных почвах её цветы синие, а на щелочных розовые.

В наше время в химии принята доктрина Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В согласии с этой теорией, кислоты — данные вещества, которые способны отщеплять протон, а основания — отдавать электронную пару OH?.
Можно сказать, что под основаниями знают соединения, которые при диссоциации в водной массе образовывают только анионы вида OH?. Если совсем просто, то щелочами именуют соединения, которые состоят из металла и гидроксид-иона OH?.
К щелочам как правило относят гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое наименование щелочей — гидроксид (гидроокись), к примеру, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые успели сложиться исторически.
Благодаря тому, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их именуют едкими: к примеру, едкий натр, едкий барий. Впрочем понятием «едкие щелочи» химики формируют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твёрдые белые вещества; гигроскопичные, водорастворимые.
Растворение в водной массе сопровождается активным выделением тепла.
Вступают в реакции с кислотами, образовывая соль и воду. Эта реакция нейтрализации считается важнейшей из всех параметров щелочей.
Помимо прочего, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, смогут выдержать температуры до +1000 °С (кроме гидроксида лития).
Гидроксид натрия (едкий натр) применяется в чистящих жидкостях, а еще (как и гидроксид калия) для изготовления мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами жиров растительного типа.
Жало осы выпускает щелочь, которую можно остановить кислотой, к примеру уксусом.
Щелочи — активные реагенты химии, поглощающие из воздуха не только пары перегретые, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота.
Окуните Лимон в Пищевую Соду — Результат Вас Удивит!
Благодаря этому сохранять гидроксиды следует в герметичной таре или, допустим, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку.
В другом случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сопоставлять щелочи по химической активности, то она возрастает во время движения по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, благодаря этому растворы щелочей не рекомендуется сохранять в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, в большинстве случаев, в полиэтиленовых емкостях.

Собственно щелочи, а не кислоты, вызывают более сильные ожоги, так как их тяжелее смыть с кожи и они проникают глубоко в ткань.
Смывать щелочь нужно неконцентрированным раствором уксусной кислоты. Работать с ними нужно в защитных средствах.
Щелочной ожог требует срочного обращения к доктору!
Использование щелочей
— В качестве электролитов.
— Для изготовления удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации водоемов.
Едкий натр. Наиболее распространенная и популярная в мире щелочь.
Используется для омыления жиров в производстве косметических и средств для мытья, для производства масел в процессе переработки нефти, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для изготовления мыла, калийных удобрений, электролитов для батареек и аккумуляторов, искусственного каучука.
Также — в качестве добавки к пище; для профессиональной чистки изделий из нержавейки.
Гидроксид алюминия.
Востребован в медицине как замечательный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике.
Помимо прочего, вещество применяется в очистительных канализационных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция.
Распространенная щелочь с очень большим спектром использования, которую в бытовых условиях знают с названием «гашеная известь».
Применяется для дезинфекции, умягчения воды, в производстве удобрений, едкого натра, «хлорки», материалов для строительства. Используется для защиты деревьев и сооружений из дерева от вредителей и огня; в пищепроме как добавка к пище и реактив во время изготовления сахара.
Гидроокись лития.
Необходимое соединение в химпроме как сырье; в стекольной, кафельной, Фиксаналырадиотехнической индустрии; для изготовления смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария.
Используется в химпроме как катализатор, а еще в пищепроме для очищения жиров, сахара.
• Кислоты и щелочи немогут мирно сосуществовать даже одну секунду, пребывав в соприкосновении.
Перемешавшись, они очень быстро начинают бурное взаимное действие.
Хим. реакция с ними сопровождается шипением и разогревом и продолжается до той поры, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам присуще образовывать кислую среду, а щелочам – щелочную.
• Химики выделяют щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Разница между кислотой и щелочью
Щелочи – это едкие, твёрдые и легкорастворимые основания. Кислоты, в основном, кислые жидкости.
Обозначение
Кислоты – непростые вещества, включающие в состав атомы водорода и кислотные остатки.
Щелочи – непростые вещества, в составе которых имеются гидроксильные группы и щелочные металлы.
Сравнение
Щелочи и кислоты – антиподы. Кислоты делают кислую среду, а щелочи – щелочную.
Они вступают в реакцию нейтрализации, благодаря которой образуется вода, а pH среда из кислой и щелочной превращается в нейтральную.
Для кислот свойственен кислый вкус, а для щелочей – мылкость.
Кислоты, растворяясь в водной массе, образовывают ионы водорода, которые формируют их свойства. Все кислоты обладают сходным поведением, вступая в химические реакции.

Щелочи при растворении образовывают гидроксид-ионы, наделяющие их отличительными характеристиками.
Щелочи привлекают из кислот ионы водорода. У щелочей есть отличительные признаки, проявляющиеся в ходе хим. реакций.
Силу щелочей и кислот формируют критерием pH.
Растворы с pH меньше 7 – кислоты, а с pH больше 7 – щелочи. Щелочи и кислоты отличают при помощи индикаторов – веществ, изменяющих цвет при соприкосновении с ними.
К примеру, лакмус синеет в щелочах и краснеет в кислотах.
Для большей достоверности опыта к щелочам приливают другой указатель – бесцветный фенолфталеин.
Он окрашивает щелочи в отличительный малиновый цвет, а с кислотами остается в постоянном виде. Классически щелочи формируют собственно фенолфталеином.
Дома кислоту и щелочь распознают, прибегая к обычному опыту.
К пищевой соде приливают жидкости и следят за реакцией. Если реакция сопровождается бурным выделением пузырьков газа, значит, в склянке находится кислота.
Щелочь же с содой, которая по собственной природе та же щелочь, не вступает в реакцию.
В чем разница между кислотами и щелочами, если они оба содержат и кислород, и водород? Про цвет в индикаторах ответ НЕ устроит?
Первое вопрос немного некорректен, как и теги вопроса, потому что бывают кислоты, а бывают карбоновые кислоты. Если же говорить о кислотах неорганической химии, то они имеют строение Hx(Ac), где H — водород, x — кол-во атомов водорода (Ac) — кислотный остаток (Пример: HCl, H2SO4, HNO3, HBr и т.д.).
Если же говорить о карбоновых кислотах, что считается органической химией, то они имеют строение R-COOH, где R — радикал (радикал это какой-нибудь гомолог), а -COOH — карбоксильная группа (Пример: CH3-COOH — кислота уксуса).
Щелочи-же это хорошо растворимые в водной массе основания. (Пример: NaOH, LiOH и т.д.). Основания имеют строение Me(OH)y, где то — число гидроксидных групп ( -OH), равное валентности металла "Me".
Кислотами называют вещества, которые способны отдавать протоны (ионы водорода), а основаниями — вещества, которые способны принимать протоны. И карбоновые кислоты и кислоты реагируют с щелочами.
Рекомендую взглянуть параграф 2.1 для более ясного знакомства с этой темой. По карбоновым кислотам, если будет интерес, думаю сам сможешь найти необходимый параграф.
http://www.explodder.info/book/chem/Химия%20-%20Пособие-репетитор%20(ред%20Егорова%202003).pdf
Карбоновые кислоты ничем особенно не выделяются от любых иных бренстедовских кислот и нет надобности выделять их в какую-то особенную группу. Механизм диссоциации в водной массе и понятие силы/слабости общее для абсолютно всех этих кислот.
В действительности вопрос очень непростой, если говорить в общем. Благодаря этому я отвечу в особенности.
Для бренстедовских кислот и оснований в водной массе.
Потому как вопрос, я подозреваю, собственно про них — в общем случае кислота не обязательно содержит протон, а основание ОН-группу. Кстати, кислород не обязательно входит в состав даже традиционной кислоты по Бренстеду (к примеру, HCl — соляная кислота).
Благодаря этому правильно выразить вопрос можно, наверняка, так: "Почему некоторые гидроксосоединения в водной массе показывают свойства кислот, а некоторые — оснований?"
Вода сама автодиссоциируется на H+ и ОН-. Другими словами, считается вместе с тем и кислотой и Основанием. Так вот, обозначение в определенном роде забавное, потому как тавтологическое: кислотой в водной массе будет более сильная (при взаимном действии с водой отдающая протон с образованием катиона гидроксония) кислота, чем вода, а Основанием в водной массе будет более сильное (при взаимном действии принимающее протон с образованием ОН-иона) основание, чем вода.
Как правило, Вы правы — если мы имеем определённое соединение Э-О-Н, то оно оказаться может и кислотой и Основанием. Зависит от того, как пойдёт процесс диссоциации при взаимном действии данного вещества с водой.
По пути Э-О + Н (кислота) или по пути Э + O-H (основание). Зависеть это будет в грубом, но удобном приближении от распределения электронной плотности в этом ансамбле:
1) если Э будет сильнее тащить плотность на себя, чем Н, то, кислород сильнее перетянет электронную плотность с водорода и связь О-Н будет сильнее поляризована и более уязвима для диссоциации (молекула воды — диполь, благодаря этому чем будет больше выборочный заряд на атомах образующих связь, тем сильнее они будут взаимодействовать с молекулами растворителя, другими словами, в таком случае воды). Это случай кислоты.
2) если, наоборот, Э слабее будет тащить, чем Н, то ситуация перевернется и для диссоциации станет более уязвима связь Э-О. Это случай основания.
Аналогичным образом, более электроотрицательные Э будут в комбинации Э-О-Н скорее образовывать кислоты, а менее электроотрицательные — основания. В промежуточных случаях будут возникать амфотерные соединения, которые выступают и как кислоты и как основания.
Это сравнительно гидроксосоединений в водной обстановке.
В общем же случае следует иметь в виду, что нет кислот и оснований "вообще", "самих по себе", существует только кислоты и основания в этих условиях.
Кислоты и щёлочи

Добрый день, друзья. Сегодня разберёмся с подобной темой: кислоты и щёлочи.
Если быть точнее, то «чем щёлочи выделяются от кислот?».
Вспомним немного о химии. Вообще, кислоты и щёлочи – это такие элементы химии, которые при соединении между собой (в правильном количестве) делают процесс нейтрализации.
Данный процесс в конце концов даёт нам воду и соль.
И выходит такое вещество, которое не относится ни к кислотам, ни к щелочам.
Оно не может вызывать ожоги.
Однако это будет исключительно при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи – это как две констрастности.
Однако они чрезвычайно важны в процессе изготовления подобных вещей как: удобрения, пластик, мыла, средства для мытья, красок, бумаги и даже взрывчаток. Это далеко не полный перечень.
Что такое кислота
Кислота — это и есть что-то кислое, оно отличается кислым вкусом. Кислота содержится в уксусе – кислота уксуса, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п.
Однако это все говоря иначе слабые кислоты, кроме них есть кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они намного опаснее для человека и пробовать их не рекомендуется никому.
Они могут разъесть одежду, кожу, вызвать тяжёлый ожог на кожных покровах, разъесть бетон и остальные вещества. К примеру, соляная кислота нам необходима для того, чтобы желудок быстрее переваривал пищу, а еще для уничтожения большинства вредных бактерий, которые приходят одновременно с пищей.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в водной массе. При этом реакция сопровождается с выделением тепла, с повышением температуры.
Если щёлочь сопоставлять с кислотой, то на ощупь она гораздо «мыльнее», другими словами скользкая.
Вообще, щёлочи не очень отстают от кислот по разъеданию и по силе. Они тоже могут без труда разъесть древесину, пластик, одежду и так далее.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не полный перечень. Щёлочь можно отыскать у себя в кухонной комнате, ну или в магазине с названием пищевая сода.
Кстати, пищевая сода это довольно хороший помощник всем домохозяйкам.
Кислоты и щёлочи – отличия
Кислоты и щёлочи выделяют по показателям pH (шкала pH). Ниже Вы видите картинку – это специализированная шкала, на которой имеются числа от 0 и до 14.
Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь.
Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10?
Серединой в большинстве случаев считают число 7 (нейтральное положение).
Другими словами числа до 7 – это все кислоты, а больше 7 – это щёлочи.

pH продуктов

Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, тогда как работа с другими подразумевает суровые меры безопасности.
Сильные кислоты – это те, которые полностью диссоциируют или ионизируются в растворах воды.
Один из вариантов визуализировать, как отличить слабые и сильные кислоты, по аналогичности с игроками в регби:
- одна сильная кислота считается игроком, который бросает мяч, как только он его получает,
- одна слабая кислота , как игрок , который получает мяч и бежит с ним.
Варианты сильных кислот
Среди популярных сильных кислот выделяют:
- HCl соляная кислота,
- серная кислота H 2 SO 4 ,
- азотная кислота HNO 3
- хлорная кислота HClO 4
- фторантимоновая кислота H [SbF 6 ]
Варианты слабых кислот
В большинстве случаев кислоты органических соединений известны как слабые:
- кислота уксуса H 3 CCOOH,
- масляная или бутановая кислота H 7 C 3 COOH (органическая кислота в масле),
- лимонная кислота или 2-гидрокси кислота 1,2,3-трикарбоксилпропан C 6 H 8 O 7,
- молочная кислота или 2-гидроксипропановая кислота H 6 C 3 O 3 .
Критерий кислотности растворов рН, механизм действия
Именно для такой шкалы разработаны специализированные индикаторы — лакмусы. Это простая полоска, которая откликается на среду.
В кислотной обстановке она красится в красный цвет, а в щелочной обстановке – в синий цвет.
Она нужна не только в химии, но и в бытовых условиях.
К примеру, если у Вас есть аквариум, то очень важную роль играет кислотность воды.
От неё зависит вся жизнь аквариума. Например, критерий кислотности воды для аквариумных рыбок меняется от 5 до 9 рН.
Если будет меньше либо больше, то рыбка себя будет чувствовать не удобно, а может и совсем скончаться.
Все это же самое и с растительностью для аквариумов…
Работа с кислотами и щёлочами

Работа с кислотами и щёлочами требует придельной внимательности и осторожности. Ведь при попадании на поверхность кожи они вызывают сильные ожоги.
Постарайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для собственной безопасности имеет смысл воспользоваться очками, перчатками и специализированной одеждой, чтобы не повредить глаза, руки и любимую одёжку)))
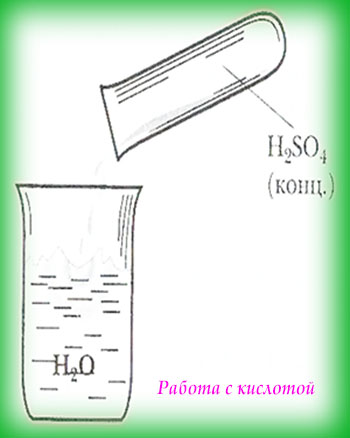
Во время работы с кислотами необходимо не забывать, что сначала вливают кислоту в раствор (воду), а не наоборот. В другом случае случится кипучая реакция, которая сопровождается брызгами.
А сам процесс добавки кислоты в раствор необходимо делать довольно медленно, при этом контролировать нагревательная степень сосуда и обязательно добавлять кислоту по стенкам сосуда.
Во время работы со щёлочами первым следует добавлять постепенно щёлочь (т.е. щелочь в воду — правильно!). Более того запрещено пользоваться стеклянной посудой, советуют фарфоровую или специализированную посуду.
При химической отделке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует при помощи специализированных устройств или инструментов, но совсем не руками, даже в том случае, если они в перчатках из резины. Кстати, щёлочь входит в состав некоторых батареек.
Помните, что при химических ожогах кожи поражённое место необходимо вымыть сильной струёй проточной воды. И целиком остановить: от кислот — 3%-ным раствором пригодной для питья соды, а щёлочь — 1%-ным раствором уксусной кислоты.

Надеюсь, теперь Вы знаете, чем отличается щёлочь от кислоты, а еще как правильно с ними работать))